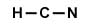
| h | Preliminar |
| Estructuras de Lewis |
Las estructuras de Lewis pueden dibujarse para todos los elementos y componentes representativos de una molécula unidos mediante enlaces covalentes.Un enlace covalente se produce cuando dos átomos comparten electrones.Si los dos átomos del enlace son iguales o tienen electronegatividad similar,los electrones son compartidos por igual entre los dos átomos y el enlace es considerado no polar.Si los dos átomos tienen electronegatividad significativamente diferente,los electrones no son compartidos por igual entre los dos átomos y el enlace es considerado como polar.En un enlace polar,el elemento más electronegativo adquiere una carga parcial negativa,y el elemento menos electronegativo adquiere una carga parcial positiva.Las cargas parciales se denotan comúnmente con la letra griega " d".
|
La electronegatividad es la medida de la capacidad de un átomo para atraer electrones. En la tabla periódica la electronegatividad aumenta de izquierda a derecha en un período.En un grupo aumenta de abajo a arriba.La mayor electronegatividad corresponde al F (3.9) y la menor al Fr (0.7) | |
Una regla (algo tosca) para determinar si un enlace covalente va a ser polar o no polar es como sigue.Si las casillas de la tabla periódica en las que se encuentran los elementos que forman el enlace covalente tienen un lado común (C y N por ejemplo),la diferencia de electronegatividades es,en general,lo suficientemente pequeña como para que el enlace entre estos dos elementos sea considerado no polar.Si las casillas de los átomos no tienen ningún lado en común (C y O por ejemplo),entonces cualquier enlace entre estos elementos es considerado como polar.Las cargas parciales en este último enlace pueden representarse por d+C–Od-.Cuando se aplica esta aproximación,el Hidrógeno (H,electronegatividad = 2.1) debería situarse entre el B (boro) y el C (carbono).
| Método para dibujar las estructuras de Lewis |
|
El Hidrógeno tiene 1 electrón en su capa exterior ,el Carbono 4 ,el Nitrógeno y el Fósforo 5 ,el Oxígeno y el Azufre 6 ,los halógenos 7. | |
|
Los átomos se unen adquiriendo la estructura del gas noble más próximo en la tabla periódica ,que para la mayoría de los elementos que intervienen en los compuestos orgánicos es el Neón, el cual posee 8 electrones en su capa más exterior. | |
Ejemplo: HCN
| Atomo | Electrones en capa exterior | Enlaces a formar |
| H | 1 | 1 |
| C | 4 | 4 |
| N | 5 | 3 |
Se dibuja el esqueleto con los átomos conectados por enlaces simples.Puesto que el C es el que más enlaces requiere se coloca en el centro.
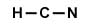
Se añaden los electrones restantes a los átomos más exteriores hasta llegar a los 10 e- totales. (No quedan electrones para colocar en el Carbono)
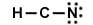
El Carbono no cumple la regla del octeto (pero el H y el N sí).Se mueven los electrones de valencia desde el N para formar un enlace múltiple entre el C y N (triple).
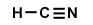
| Carga formal |
Los átomos más comunes en los compuestos orgánicos suelen formar un número determinado de enlaces ( C 4 enlaces, N 3 enlaces, O 2 enlaces, H y halógenos 1 enlace). Cuando dichos átomos forman un número de enlaces que no es el indicado, para que la contabilidad de electrones sea coherente, es necesario colocar en ellos una carga formal que se indica mediante un un signo + ó un signo - en las cercanías del átomo correspondiente.La fórmula para calcular la carga formal de cada átomo es la siguiente:
CARGA FORMAL = Nº de electrones en capa exterior - 1/2 electrones de enlace - electrones no enlazantes
Por ejemplo:
|
Nº de electrones en capa exterior para el C = 4 |
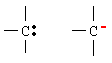
|
|
Nº de electrones en capa exterior para el C = 4 |
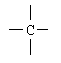
|
|
Nº de electrones en capa exterior para el C = 4 |
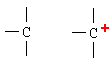
|
La carga formal de una molécula es la suma algebraica de las cargas formales de los átomos que la constituyen, en consecuencia una molécula puede ser neutra aunque los átomos que la componen no lo sean.
| Resonancia |
Existen diversas moléculas cuyos electrones no parecen estar localizados en posiciones fijas (dadas por las estructuras de Lewis) sino dispuestos en diferentes posiciones.La teoría de la resonancia explica esto suponiendo que dichas moléculas son un compuesto intermedio entre una serie de estructuras moleculares llamadas formas resonantes.Cada una de ellas,por sí misma,no existe,existe el conjunto llamado híbrido de resonancia.
Por ejemplo,los electrones en el ión acetato (CH3CO2-) pueden considerarse como localizados en dos diferentes disposiciones (como se muestra más abajo).Ambas estructuras contienen un enlace C = O,que se supone más fuerte y más corto que el enlace simple,y un enlace C – O simple.Experimentalmente,ambos enlaces C O parecen tener la misma longitud,y ésta es aproximadamente la media entre la longitud esperada para el enlace simple C – O y la esperada para el doble enlace C = O.La explicación a esto,basándose en la teoría de la resonancia,es que esta molécula tiene dos formas resonantes cada una de las cuales aparece el 50% del tiempo.
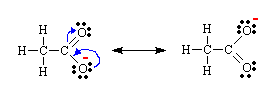
El híbrido de resonancia posee una menor energía (y por tanto es más estable) que cada una de las formas resonantes.
Las distintas formas canónicas o resonantes deben tener el mismo número y la misma clase de núcleos de átomos y el mismo número de electrones.La diferencia entre unas formas canónicas y otras se encuentra exclusivamente en la posición de los electrones.
Para que exista resonancia deben existir al menos dos formas resonantes que tengan energía similar,si no la molécula quedaría perfectamente representada por la de menor energía que sería la predominante.
Cuanto mayor sea el número de formas resonantes la molécula será más estable.
Toda molécula que sólo posea enlaces simples no tiene formas resonantes.Las moléculas con enlaces múltiples pueden tener formas resonantes o no.
La resonancia estabiliza las moléculas e iones,lo cual puede puede explicar diversas tendencias de las reacciones químicas.De dichas tendencias se induce lo siguiente:
1.Si un reactivo (material de partida) está estabilizado por resonancia,las reacciones químicas de esta molécula estarán menos favorecidas que en ausencia de resonancia.
2.Si un producto (material resultante) está estabilizado por resonancia,las reacciones de las que se obtiene estarán más favorecidas.
| Acidos y bases |
|
Según la teoría de Bronsted-Lowry:: Ácido es todo compuesto capaz de ceder un protón. Base es todo compuesto capaz de aceptar un protón. | |
|
Según la teoría de Lewis: Ácido es toda sustancia capaz de aceptar un par de electrones. Base es toda sustancia capaz de ceder un par de electrones. | |
Aunque la teoría de Lewis parece diferente, es coherente con otras teorías.La teoría de Bronsted-Lowry se refiere al ión H+.La definición de Lewis se refiere a los pares de electrones (que conllevan una carga negativa).En la teoría de Bronsted-Lowry es el protón H (H+) el que se mueve.En la teoría de Lewis,los electrones forman enlaces,que "tiran" de los átomos para llevarlos a sus nuevas posiciones.
| -------------- | Acido | Base |
| Bronsted-Lowry | donante de H+ | receptor de H+ |
| Lewis | receptor de e- | donante de e- |