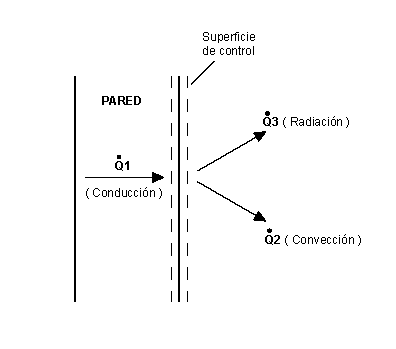
- La cantidad de calor transferido por unidad de tiempo es la velocidad de transferencia de calor y en este documento se denota por Q-punto que es lo mismo que
- Conocida la velocidad de transferencia de calor se puede determinar la cantidad de calor transferida en un intervalo de tiempo por:
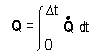
- Si Q-punto es constante, entonces Q = Q-punto * Dt